|
Struktura chemiczna tej substancji jest natomiast podobna do chityny [1-6]. Dokładniejsze poznanie budowy czarnego korala ma także aspekt aplikacyjny. W ostatnich latach wzrosło bowiem zainteresowanie polimerami pochodzenia naturalnego wraz z zapotrzebowaniem na produkty o charakterze ekologicznym, czyli przyjazne środowisku. Jedną z cech takich tworzyw naturalnych jest ich biodegradowalność.Cechę tę ma także chityna. Ponadto otrzymany z chityny chitozan, dzięki swym właściwościom, takim jak bioaktywność, wspomniana biodegradowalność, błono- i włóknotwórczość, właściwości sorpcyjne i chelatujące, może być wykorzystywany w wielu dziedzinach, jak ochrona środowiska, przemysł kosmetyczny, medycyna i farmacja, przemysł spożywczy, rolnictwo, biotechnologia, przemysł włókienniczy i papierniczy [7]. Eksploatacja przemysłowa nie będzie jednak niewątpliwie dotyczyć czarnego korala, ale innych źródeł chityny - polisacharydu powszechnie występującego w naturze. W światowym przetwórstwie bezkręgowców morskich można pozyskać np. z odpadów ok. 150 000 t chityny rocznie.
Chityna, jak i inne biopolimery o podobnej budowie pierścieniowej, np. celuloza czy mureina, mają zbliżoną funkcję w organizmach żywych, stanowiąc materiał strukturalny i pełniąc rolę ochronną.
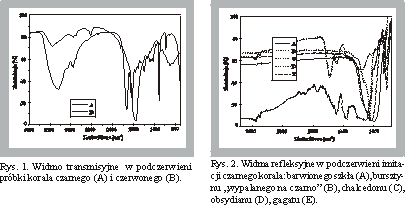
Analiza spektroskopowa w podczerwieni (IRS) czarnego korala pochodzącego z wybrzeży Kuby (gęstość względna 1,360) wskazała na praktycznie całkowicie organiczną budowę badanej próbki, prezentując intensywne pasma grup amidowych przy 1657 i 1513 cm-1 (rys. 1A). Analiza termiczna czarnego korala wykazała wyraźne podobieństwo jego derywatogramu z derywatogramem uzyskanym dla chityny wyseparowanej ze skrzydeł owadów.
Pod wypływem stężonego kwasu solnego uzyskano całkowite przeprowadzenie czarnego korala do roztworu.

Analiza rentgenowska nie wykazała obecności substancji mineralnej, natomiast szerokie pasmo które pojawiło się na rentgenogramie, może świadczyć o częściowo uporządkowanej strukturze materii organicznej tworzącej czarny koral.
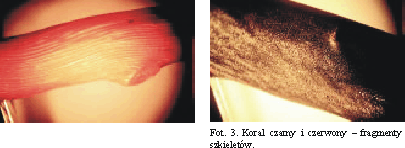
Ze specyfiką struktury i silną absorpcją światła widzialnego wiąże się też prawdopodobnie czarna barwa korala, który po roztarciu wykazuje brunatnooliwkowy kolor. Barwa, jaką ukazuje szesnastokrotnie powiększony obraz cienkiego szlifu czarnego korala, uzyskany w świetle odbitym i przechodzącym, jest odpowiednio czerwonobrunatna i żółtoczerwona (fot. 6, 7). Dla porównania na fot. 8 i 9 przedstawiono także odpowiednie obrazy korala czerwonego.
Czarny koral jest objęty pełną ochroną gatunkową, co powoduje pojawianie się imitacji. Takimi imitacjami mogą być np. czarny chalcedon, obsydian, barwione szkło, gagat, "wypalony na czarno" bursztyn (fot. 10). Nieniszcząca refleksyjna technika spektroskopii w podczerwieni może być wykorzystana do identyfikacji tych imitacji w gotowych wyrobach.Zarejestrowane widma wskazują wyraźne różnice kształtu (rys. 2) względem widma IRS czarnego korala. Widmo chalcedonu, będącego skrytokrystaliczną odmianą SiO2, wyróżnia silne, ale wąskie pasmo przy 1060 cm-1 pochodzące od grup Si-0, zaś widma obsydianu (szkliwa wulkanicznego) oraz szkła wykazują bardzo szerokie pasmo tych ugrupowań, przesunięte do niższych wartości liczb falowych. Gagat natomiast (węgiel brunatny [8] powstały z tkanki drzewnej przeobrażonej w wyniku procesów humifikacji i bituminizacji [9], charakteryzują w widmie silne pasma ugrupowań organicznych przy 1610, 1437, 1110-1260 cm-1. Inny z kolei kształt widma jest właściwy dla bursztynu "wypalonego na czarno" (charakterystyczne pasma: 1720, 1600, 1184-1277, 1380 cm-1).
Także w przypadku korali o szkielecie wapiennym pojawiają się imitacje, jak np. przedstawiony na fot. 11 przekrój sztucznie barwionego na czerwono tzw. korala "chińskiego" (widmo IRS wskazało na jego kalcytowy szkielet).



Sama natura również dostarcza różnobarwnego materiału, kiedy to na przykład obecność pierwiastków śladowych może spowodować pojawienie się zabarwienia. Na przykład występowanie naturalnie zabarwionych niebieskich korali (o szkielecie kalcytowym według widma IRS) nie jest zaskakujące, jeśli porównać je z istniejącą w naturze niebieską odmianą kalcytu (fot. 12).
Interesująca kolorystycznie jest też naturalna czerwona odmiana korala zwana nieszlachetną (fot. 13, szkielet kalcytowy według widma IRS).
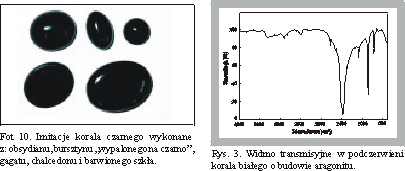
Białe współczesne szkielety koralowe z wybrzeży Australii wykazały w podczerwieni strukturę aragonitu (rys. 3).
Lokalizacja koralowców związana jest z możliwościami dostępu do pożywienia oraz egzystencji w środowisku sprzyjającym wzrostowi. Wiele koralowców tworzy rafy w przezroczystych i płytkich wodach ciepłych mórz, gdzie powstaje układ endosymbiotyczny z jednokomórkowymi algami zooksantellami. Te ostatnie, żyjąc licznie w entodermie koralowców i korzystając z jej ochrony, wykorzystują do fotosyntezy dwutlenek węgla wytwarzany podczas oddychania koralowców oraz będący produktem ubocznym reakcji tworzenia wapiennego szkieletu. Zapobiega to rozpuszczaniu wapiennego szkieletu już wytworzonego przez koralowiec w obecności nadmiarowej ilości dwutlenku węgla. Do fotosyntezy niezbędny jest dostęp światła słonecznego, stąd korale tworzące z algami fotosymbiozę muszą znajdować się w strefie fotycznej. Dla zapewnienia wzrostu szkieletu (kalcyfikacji) strefy ich występowania muszą cechować się ponadto wysokim stopniem nasycenia jonami Ca2+ oraz węglanowymi.

Można więc przypuszczać, iż z kolei tworzenie organicznego, konchiolinowego szkieletu tzw. czarnych korali mogło następować w warunkach większego dostępu do polipów materii typu węglowodanów i aminokwasów, przy mniejszym natomiast stężeniu jonów mogących utworzyć węglan wapnia. Na fot. 14 przedstawiono pochodzącą z wybrzeży Japonii gałązkę tzw. czarnego korala (prezentowany okaz nie wykazuje jednak czarnej barwy, jak pokazane wcześniej) z wyraźną kalcytową inkrustacją. Po usunięciu kalcytu za pomocą rozcieńczonego kwasu solnego próbka ta wykazała w podczerwieni widmo podobne do uzyskanego dla omawianego wcześniej korala czarnego. Znaczna zaś kalcyfikacja omawianej próbki ma charakter raczej zewnętrzny i mogła być procesem wtórnym.
Podsumowując, należy stwierdzić, iż zastosowanie analizy spektrofotometrycznej w podczerwieni (zwłaszcza wykonywanej nieniszczącą techniką refleksyjną) spełniło dobrze swoje zadanie dotyczące charakterystyki, identyfikacji i rozróżnienia czarnego korala od jego imitacji. Problemem pozostaje jednak nadal bardziej szczegółowe rozpoznanie chemicznej struktury organicznego szkieletu tzw. czarnych korali. Temu celowi mogłaby służyć m.in. trudno jeszcze dostępna w Polsce analiza metodą magnetycznego rezonansu jądrowego dla ciała stałego.

* Uniwersytet Śląski, Wydział Nauk o Ziemi
* * Uniwersytet Śląski; Instytut Fizyki
* * * Pracownia Gemmologiczna, Chorzów
Literatura:
[1] B. Günter: Bestimmungstabellen für Edelsteine, Synthesen, Imitationen. Yerlagsbuchhandlung Elisabeth Lenzen-Kirschweiler, 1976.
[2] W. Schumann: Edelsteine u. Schmucksteine BLV. Yerlagsgesellschaft, München, Wien, Zurich 1976.
[3] W. Heflik, L. Natkaniec-Nowak: Zarys gemmologii. AGH, Kraków 1992.
[4] N. Sobczak, T. Sobczak: Kość słoniowa. Korale. Wyd. T. Sobczak, Warszawa 1995.
[5] M. Michalski, J. Stolarski: Paleofakty. Wyd. RTW, Warszawa 1998.
[6] V. Bouska, P. Jakes, T. Paces, J. Pokorny: Geochemie. Acad. Praha 1980.
[7] E.M. Siedlecka, I. Bojanowska: Chityna i chitozan jako aktywne biopolimery "Laboratoria, Aparatura, Badania" 2000, 5(2) 32-34.
[8] B. Kosmowska-Ceranowicz, Z. Migaszewski: O czarnym bursztynie i gagacie "Przegląd Geologiczny" 1988, 7, 413-421.
[9] L. Chodyniecka, W. Gabzdyl, T. Kapuściński: Mineralogia i petrografia dla górników. ŚWT, Katowice 1993.
Spis rysunków (pliki 14G Czarny rys. 1-3):
Rys. l. Widmo transmisyjne w podczerwieni próbki korala czarnego (A) i czerwonego (B).
Rys. 2. Widma refleksyjne w podczerwieni imitacji czarnego korala: barwionego szkła (A), bursztynu "wypalanego na czarno" (B), chalcedonu (C), obsydianu (D), gagatu (E).
Rys. 3. Widmo transmisyjne w podczerwieni korala białego o budowie aragonitu.
Spis fotografii: Fot. l. Gałązki korala czerwonego, czarnego i białego.
Fot 2. Gałązki korala czarnego.
Fot. 3. Koral czarny i czerwony - fragmenty szkieletów.
Fot 4. Gałązki i wyroby z korala czarnego.
Fot. 5. Przekrój poprzeczny gałązki czarnego korala z zatoki Akaba (Morze Czerwone) narośniętej na muszli małża. (na CD ROM-ie opisana, jako "x")
Fot 6. Płytka z korala czarnego (światło odbite, x l6).
Fot 7. Płytka z korala czarnego (światło przechodzące, x l6).
Fot 8. Płytka z korala czerwonego (światło odbite, x l6).
Fot 9. Płytka z korala czerwonego (światło przechodzące, x l6).
Fot 10. Imitacje korala czarnego wykonane z: obsydianu, bursztynu "wypalonego na czarno", gagatu, chalcedonu i barwionego szkła. (na CD ROM-ie opisane, jako "koraliki czarne")
Fot 11. Koral "chiński" sztucznie barwiony (przekrój paciorka). na CD ROM -ie opisany, jako "barwiony")
Fot 12. Paciorki wykonane z niebieskiego korala i niebieski kalcyt. (na CD ROM-ie opisane, jako "niebieski l")
Fot 13. Gałązka korala czerwonego nieszlachetnego i wykonany zeń paciorek (na CD ROM-ie opisane, jako "koral czer.")
Fot 14. Gałązka "czarnego" korala z wybrzeży Japonii. (na CD ROM-ie opisany, jako."gałązka"),
Fotografie: nr 1-4, 6-9: J. Ożdżeński; nr 5, 10-14: E. Teper
|


