
|
Na okładce: Mariusz Gliwiński,
AMBERIF DESIGN AWARD - "Amberif `99" |
| W NUMERZE |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Struktura własnościowa światowych producentów metali szlachetnych w 1999 r. |
|
Joanna Kulczycka, Anna Wąsik |
|
Bursztyn czy polimer? A. Matuszewska * , R. Wrzalik ** , A. Hacura** źródłem bursztynu są naturalne żywice, które mogły służyć roślinom jako antybiotyk przeciw wirusom, balsam gojący skaleczenia i rodzaj plastra osłaniającego uszkodzenia. Wyciek żywicy mógł być ponadto reakcją obronną żywego organizmu rośliny wobec zmian warunków fizyczno-chemicznych w otoczeniu, jak na przykład gwałtowne zmiany temperatury czy zmiana składu otaczającej atmosfery. Służąc z natury ochronie rośliny, żywica utwardzona na powietrzu stawała się odporna na czynniki zewnętrzne. Dlatego przetrwała wiele milionów lat. Ulegała jednak pewnym przemianom w różnym stopniu zależnym od środowiska depozycji. Woda morska zabezpieczała od dostępu tlenu z powietrza, jednak zarówno sole morskie, jak i obok powstający glaukonit znany dziś z "niebieskiej ziemi" mogły przyspieszać reakcje transformacji, zwłaszcza w powierzchniowej warstwie bryłek bursztynu. Poddany natomiast działaniu powietrza i promieniowania ultrafioletowego nabierał bursztyn odcieni czerwieni i brązu, a bogactwo barw i podatność na obróbkę czyniło go już w starożytności poszukiwanym i cennym materiałem jubilerskim. Prekursorami ozdób były prawdopodobnie bursztynowe amulety chroniące przed wszelkim złem. Bardziej wiarygodną ochronę stanowiły jednak odkryte dość wcześnie lecznicze walory bursztynu. Wynikają one m.in. z obecności kwasu bursztynowego i jego soli. Stwierdzono ponadto, iż kwas bursztynowy w sukcynicie może stanowić również biostymulator wzrostu roślin uprawnych [1]. Kwas bursztynowy może być produktem utlenienia w okresie postsedymentacyjnym [2] albo też składnikiem pierwotnym sukcynitu. Tę drugą możliwość wydają się potwierdzać częściowo wyniki niektórych badań wykonanych dla współczesnych owoców, które poddawano działaniu niskich temperatur albo przechowywano w atmosferze o podwyższonej zawartości CO 2 . Ting i Attaway [3] stwierdzili na przykład podwyższoną zawartość kwasu bursztynowego w pomarańczach uszkodzonych przez mróz. Obserwacji tej nie potwierdziły jednak podobne badania Shawa [4]. Natomiast kwas bursztynowy nieobecny w jabłkach nieuszkodzonych pojawił się w jabłkach uszkodzonych w wyniku przechowywania w atmosferze o wysokiej zawartości CO 2 [5]. Tego typu badania mogłyby pozwolić także na wyjaśnienie intensywnego żywicowania roślin jako ewentualnej reakcji obronnej przeciwko gwałtownemu ochłodzeniu klimatu albo znacznemu zwiększeniu koncentracji dwutlenku węgla w atmosferze (na przykład wskutek aktywności wulkanicznej). Jedną z prawdopodobnych przyczyn dużego wycieku żywic mogłoby być także rozległe niszczenie kory żywicujących drzew stanowiącej pokarm zwierząt roślinożernych. Mimo stosunkowo dużych zasobów bursztynu, na rynku zdarzają się także jego imitacje. Względnie prostym sposobem identyfikacji żywic naturalnych i sztucznych jest spektroskopia w podczerwieni (IR). Bezbłędnie pozwala ona wskazać na przykład sukcynit dzięki obecności w jego widmie IR tzw. ramienia bałtyckiego w zakresie 1150-1260 cm -1 [6], jak to można zaobserwować na widmie IR sukcynitu z wybrzeża Bałtyku i z Ukrainy. Widmo poliakrylanu izobutylu jest zbliżone kształtem, co może świadczyć o podobieństwie głównych grup strukturalnych z bursztynem bałtyckim, jednak łatwo tu odróżnić widmo żywicy naturalnej i polimeru. Budowie bursztynu przypisuje się czasem strukturę poliestru [7]. prezentuje widmo IR poliestru Polimal 123 pochodzącego z Zakładów Chemicznych w Sarzynie. Widmo to jednak różni się znacznie względnymi intensywnościami pasm zarówno od widma sukcynitu (żywica trzeciorzędowa), jak i od widm IR żywic kopalnych starszych z osadów wieku kredowego. Wyraźne podobieństwo kształtu widm naturalnej żywicy i polimeru syntetycznego obserwuje się natomiast w przypadku
zygburgitu i polistyrenu.
|
|
|
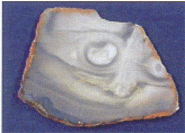
|
| Sukcynit (wybrzeże Bałtyku, trzeciorzęd), płytka szlifowana dwustronnie
|
|

|
| Żywica kopalna z Hiszpanii (Galicja, Reocin, Torrelavega, Asturian de Zinc, kreda).
|
|

|
| Żywica kopalna z USA (Sayreville, New Jersey, Raritan, kreda)
|
|
Zygburgit jest od dawna znany jako naturalny polistyren, co wykazano m. in. na podstawie widma w podczerwieni [6, por też "PJ" 3 (11), 2000, s. 20-21]. Różnica polega głównie na obecności w widmie zygburgitu pasma przy 1730 cm -1 , które może pochodzić na przykład od kwasu cynamonowego zidentyfikowanego w tego typu żywicy już w 1885 r. przez Klingera i Pitschkego [6, loc. cit. ]. (Kwas ten o wzorze: C6H5CH=CHCOOH, obecny w wydzielinie roślinnej, mógł dać w wyniku polimeryzacji żywicę o charakterze naturalnego polistyrenu). Zewnętrzna charakterystyka zygburgitu wykazuje dość specyficzne cechy, jak niejednolite beżowo-brązowe zabarwienie i wyraźna porowatość powierzchni. Poza swoistym "odciskiem palca", jaki stanowi dla charakterystyki żywicy widmo w podczerwieni, wykorzystana tu metoda spektroskopowa IR ma dodatkowy aspekt praktyczny, polegający na możliwości niedestrukcyjnego pomiaru, jeśli dostępny jest przyrząd z przystawką do zastosowania techniki odbiciowej. W tym przypadku jednakże powierzchnia próbki powinna mieć dostateczną zdolność odbicia światła. Ta nieniszcząca technika pomiaru może być szczególnie użyteczna dla badania okazów muzealnych i cennych próbek jubilerskich. Technika odbiciowa może być użyta zarówno w przypadku wykorzystania tzw. "średniego" [8], jak i "bliskiego" zakresu podczerwieni (NIR) [9,10].
Literatura:
[1] W. S. Trofimow: Amber. Niedra, Moskwa 1974. [2] J. Szykuła, C. Hebda, J. Orpiszewski, R. Aichholz, A. Szynkiewicz: Studies on neutral fraction of Baltic amber. "Prace Muzeum Ziemi" 1990, 41: 15-20. [3] S. V. Ting, J. A. Attaway: Citrus fruits. W: A. C. Hulme (red): The Biochemistry of Fruits and their Products. Vol. 2. Academic Press, New York 1971: 107. [4] P. E. Shaw, Ch. W. Wilson, R. W. Hansen: H. p. l. c. determination of trace levels of succinic acid in orange juice from freeze-damaged and undamaged fruit. "Journal of the Science of Food and Agriculture" 1987, 41: 153158. [5] A. C. Hulme: Carbon dioxide injury and the presence of succinic acid in apples. "Nature" (Lond.) 1956, 78: 218-219. [6] B. Kosmowska-Ceranowicz: Succinite and some other fossil resins in Poland and Europe. "Estudos del Museo Ciencias Naturales de Alava", 1999, 14 (2): 73-117. [7] N. R. Vavra: Gas liquid chromatography
- an effective tool to the chemical characterization of fossil resins. "Prace Muzeum Ziemi" 1990, 41: 4-14. [8] A. Matuszewska, R. Wrzalik, A. Hacura: Reflection micro-FT IR spectroscopy of fossil resins and synthetic polymers. "Prace Muzeum Ziemi" 2001, 46 (w druku). [9] A. Golloch, S. Heidbreder, Ch. L.hr: Identification of amber and imitations by near infrared reflection spectroscopy. "FreseniusO Journal of Analytical Chemistry" 1998, 361: 545-546. [10] R. Wrzalik, A. Hacura, A. Matuszewska: Fossil resins and synthetic polymers
- NIR spectroscopy study. III International Conference: "Vibrational Spectroscopy in Materials Science", Materiały Konferencyjne, Kraków, 23-26 września 2000. [11] Ch. J. Pouchert: The Aldrich library of infrared spectra. Ed. II, 1970. * Uniwersytet Śląski, Wydział Nauk o Ziemi, ul. Będzińska 60, 41-200 Sosnowiec ** Uniwersytet Śląski, Instytut Fizyki, ul. Uniwersytecka 4, 40-007 Katowice
|
|

|
![]()